Les potentiels électrochimiques de Ox et Red sont alors inchangés :
celui de l'électron dans le platine devient :
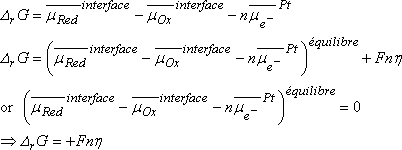
En conséquence, l'enthalpie libre de réaction s'exprime :
Energie d'activation et potentiel électrique
Lorsque l'équilibre est établi l'enthalpie libre d'activation est D¹Géquilibre, la différence de potentiel entre les deux phases étant DFéquilibre.
Si on modifie cette différence de potentiel en ajoutant une surtension h, le système est hors d'équilibre.
Supposons que le potentiel du Pt est élevé de h, celui de la solution restant identique.
Les potentiels électrochimiques de Ox et Red sont alors inchangés :
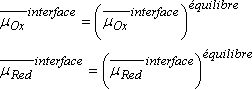
celui de l'électron dans le platine devient :

En conséquence, l'enthalpie libre de réaction s'exprime :

Comment l'état activé est il affecté par la surtension ?
On admet que l'influence de h se traduit sur les énergies d'activation anodique (réaction d'oxydation) et cathodique (réaction de réduction) par :
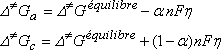
a est le coefficient de transfert de charge.
Ce qui peut être représenté par le schéma suivant :
En exprimant h à partir des potentiels d'électrode : h = E-Eéquilibre on obtient pour l'expression des constantes de vitesse :