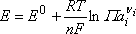Relation de Nernst et autres conséquences thermodynamiques
Si nous exprimons les potentiels chimiques en fonction
des activités :
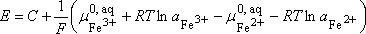
soit :
 c'est
la relation de Nersnt
c'est
la relation de Nersnt
E0 est le potentiel standard du système étudié, défini par
rapport à l'ESH.
Pour des systèmes plus complexes :
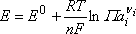
n est le nombre d'électrons échangés et la réaction électrochimique
est écrite dans le sens de la réduction.
Nous allons maintenant nous intéresser à la cellule :
Pt|Fe2+, Fe3+|Ce3+, Ce4+|Pt
à gauche selon la convention indiquée plus haut
:
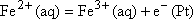 c'est
une oxydation
c'est
une oxydation
à droite :
 c'est
une réduction
c'est
une réduction
le bilan du fonctionnement de la cellule est
:

Ecrivons la f.e.m. de la cellule dans les conditions
standard :
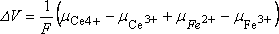
par analogie avec le cas précédent (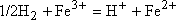 ) et si le potentiel de jonction est négligeable :
) et si le potentiel de jonction est négligeable :
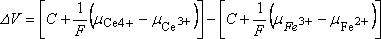
Þ 
si DV>0
soit E(Ce4+/Ce3+) > E(Fe3+/Fe2+)
la transformation se fera spontanément dans le sens
: 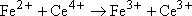
si DV=0
soit E(Ce4+/Ce3+) = E(Fe3+/Fe2+)
le système est en équilibre
L'enthalpie libre de la réaction chimique associée
à la pile est :

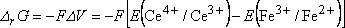
cette relation est souvent écrite 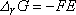 , E y désigne la f.e.m. de la pile et non un potentiel d'électrode !
, E y désigne la f.e.m. de la pile et non un potentiel d'électrode !
c'est la différence des deux potentiels d'électrode associés aux couples cathodique
et anodique :
E=E(couple cathodique)-E(couple
anodique)
Dans les conditions standard :
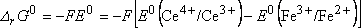
et comme 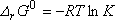
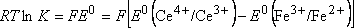
D'une façon plus générale si n électrons sont
mis en jeu :
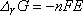
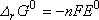
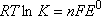
![]()
![]() c'est
la relation de Nersnt
c'est
la relation de Nersnt