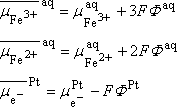Thermodynamique de la réaction électrochimique et
potentiel d'électrode
Considérons une réaction électrochimique simple :
Fe3+(aq) + e-(Pt) = Fe2+(aq)
Pour traiter ce cas, il faut prendre en compte dans l'expression
de l'enthalpie libre le travail des forces électriques pour amener l'espèce
chargée du potentiel électrique F=0 (à l'infini)
à son potentiel électrique dans sa phase.
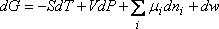
On introduit la notion de potentiel électrochimique  défini
de la façon suivante:
défini
de la façon suivante:
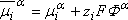
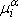 est le potentiel
chimique de i dans la phase a,
est le potentiel
chimique de i dans la phase a,
zi le nombre (algébrique) de charges
F est le Faraday (charge d'une mole d'électrons)
Fa le potentiel électrique de la phase
a dans laquelle se trouve le soluté
Nous aurons donc :
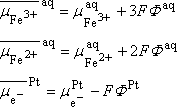
A l'équilibre : dG=0
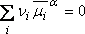
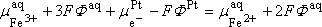
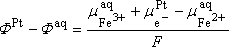
c'est la différence de potentiel à l'interface Pt/solution
aqueuse
On ne sait mesurer que des différences de potentiel,
on associe le système étudié à un système électrochimique de référence pour
former la cellule galvanique :
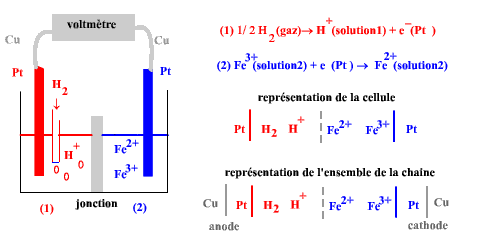
Par convention on affecte, dans la représentation le rôle d'anode à l'électrode
de gauche .
Nous allons chercher l'expression de la f.e.m. de la pile ainsi constituée,
c'est à dire la différence de potentiel DV
, mesurée entre les deux bornes en l'absence de courant (voltmètre de grande
impédance d'entrée).
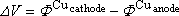
On montre que :
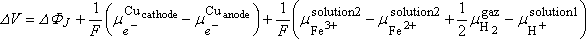
L'animation ci-dessous détaille la démonstration de cette formule en présentant
la succession des interfaces rencontrées pour aller de la cathode à l'anode
dans la cellule, et en donnant l'expression des ddp interfaciales correspondantes
en fonction des potentiels chimiques et de DFJ.
La somme de ces ddp conduit à l'expression ci-dessus.
Examinons les différents termes :
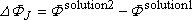
c'est un potentiel de jonction liquide,
il dépend de la conception de la cellule et des concentrations des électrolytes
présents dans les solutions.
On s'efforce de le rendre aussi petit que possible
: 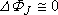
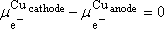
car les deux fils conducteurs sont identiques
chimiquement

C est une
constante si on utilise toujours la même électrode de référence
Il s'agit de l'électrode standard à hydrogène (ESH ou SHE son abréviation
anglaise) : solution de référence de HCl, aH+=1, sous
une pression d'hydrogène égale à la pression de référence (1bar) et
électrode de platine platiné.
D'où :
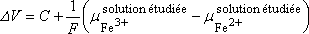
La ddp DV
mesurée dans ces conditions, qui est la f.e.m. de
la pile, reflète les caractéristiques électrochimiques
du système étudié.
C'est donc ainsi que l'on définit les propriétés du système, on
appelle cette f.e.m. "potentiel de l'électrode" ou, par extension,
"potentiel du système redox" et on le note E.
La notation "E" et le terme "potentiel" ne doivent
pas faire oublier qu'il s'agit d'une ddp, le "potentiel E" s'exprime
par rapport à l'électrode de référence ESH.
On peut retenir que E est la f.e.m. de la pile constituée par la ESH,
fonctionnant en oxydation et l'électrode associée au système électrochimique.
Exemple :
système : Ox(solution) +ne-(Pt)
=Red (solution)
électrode associée au système : Pt|Ox,Red
E(Ox/Red) =
Eélectrode est la f.e.m. de la pile :
Pt|H2,H+|Ox,Red|Pt
dont l'équation chimique bilan est :
1/2n H2+ Ox = 1/n H++ Red
![]()
![]() défini
de la façon suivante:
défini
de la façon suivante: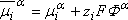
est le potentiel chimique de i dans la phase a,