
Quelques notions de thermodynamique de la réaction chimique
Soit un réaction chimique exprimée de la façon la plus générale :
La fonction thermodynamique qui permet d'étudier l'évolution d'un système chimique est l'enthalpie libre ou fonction de Gibbs G, dont la variation, lors d'une transformation changeant la composition est :
mi est le potentiel chimique de l'espèce i et dni la variation de sa quantité lors de la transformation envisagée.
A T et P constantes, ce qui est
le cas ici, ![]()
Lors d'une réaction chimique les dni ne
varient pas indépendamment : dni = ni dx ,
x étant l'avancement de la réaction,
l'expression de dG devient ![]()
Si dG < 0 la transformation est possible spontanément
Si dG=0 l'équilibre est réalisé : ![]()
Expression du potentiel chimique selon l'espèce considérée :
Pour une espèce "corps pur", c'est à dire unique constituant de sa phase :
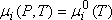
le potentiel chimique reste égal au potentiel chimique standardPour le solvant, l'eau dans le cadre de ce cours :
le potentiel chimique est celui du solvant purPour un soluté neutre de concentration ci :
ai est l'activité, gi le coefficient d'activité
et c0 la concentration de l'état de référence choisi (1mol.L-1).On omettra ensuite d'écrire c0 et en se souvenant que ci est en mol.L-1.
Pour un soluté chargé, de concentration ci et de nombre de charge (algèbrique) zi :

Le calcul du coefficient d'activité fait intervenir la force ionique
calculée en prenant en compte toutes les espèces présentes, en fait seuls les ions interviennent réellement car zi=0 pour les espèces neutres.
si I<0,02
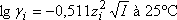
Notons que si on effectue des transformations en fixant la valeur de la force ionique, les coefficients d'activités des espèces chargées seront fixés.
C'est ce que l'on appelle : travailler à force ionique fixée.Pour un gaz dans un mélange gazeux :
On peut omettre le terme p0 si la fugacité est exprimée en bar.