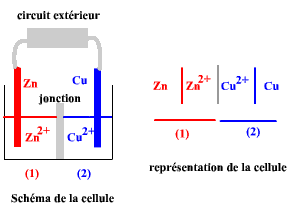
Cellule électrochimique galvanique
La figure 1 est constituée d'un schéma de cellule et de sa représentation conventionnelle.
La cellule comporte deux compartiments séparés, reliés par une jonction électrolytique. Cette jonction permet la conduction de la solution, et donc le passage du courant, tout en empêchant le transport des ions d'un compartiment à l'autre.
Le circuit extérieur complète le montage.
Ici il n'inclut aucun générateur, ni récepteur, les électrons pourront y
circuler d'autant plus librement que la résistance sera faible.
La figure 2 montre un fonctionnement possible :
L'oxydation du Zn et la réduction du Cu2+ provoquent une circulation des électrons dans le circuit extérieur du Zn (pôle négatif) vers le Cu (pôle positif).
Le bilan global des deux réactions électrochimiques est :
Zn + Cu2+ ® Zn2+ + Cu
Cette réaction chimique est spontanée de gauche à droite, et la pile fonctionne effectivement comme décrit plus haut (Pile Daniell).
Une telle cellule est appelée "cellule galvanique"
(ou pile dans un contexte plus technologique).
Elle joue le rôle de générateur.