![]()
Le terme ai désigne l'activité de l'espèce i.
Réaction redox en solution
Prenons l'exemple d'une réaction redox simple :
Fe2+ + Ce4+ = Fe3+ + Ce3+
Il s'agit du transfert d'un électron d'un ion Ce4+ à un ion Fe3+.
A cette réaction est associée une constante d'équilibre K(Fe2+ + Ce4+ = Fe3+ + Ce3+) dont la valeur, qui ne dépend que de la température, est liée à l'enthalpie libre standard de réaction DrG0(T) par la relation :
DrG0(T) + RTlnK(T) = 0.
Par ailleurs :
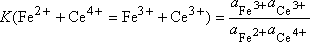
Le terme ai désigne l'activité de l'espèce i.
On introduit la notion de demi-réaction redox, définissant un couple oxydoréducteur Ox/ Red échangeant n électrons selon l'équation :
Ox + ne- = Red
qu'il serait plus exact d'écrire Oxz ne- = Redz-n, z étant le nombre de charge de l'oxydant (avec son signe)
On ne peut définir une constante pour cette réaction car les électrons ne peuvent exister librement en solution.
En revanche on définit le potentiel standard E0 du couple, et le potentiel d'une solution donnée de Ox et Red s'exprime selon la relation de Nernst :
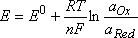
E0 dépend de la température, le terme standard indiquant que la valeur de la pression dans les conditions de l'expérience est égale à celle de la pression de référence (1 bar, soit 105 Pa). Lorsque la température est de 25°C, E0 est appelé "potentiel normal" dans beaucoup de textes français.
Le potentiel E est mesurable, c'est la ddp entre deux électrodes plongeant dans la solution : une électrode en équilibre électrique avec la solution et l'électrode de référence ESH (Electrode Standard à Hydrogène) appelée aussi EHN (Electrode à Hydrogène Normale) lorsque la température est de 25°C.
La signification de E ne peut être comprise qu'en étudiant la thermodynamique de la réaction électrochimique qui va être traitée plus loin.
Si nous revenons à la réaction redox, on constate qu'elle est la résultante de deux demi-réactions et que l'on peut relier K aux potentiels standard des deux couples redox engagés dans la réaction :
Fe3+ + e- = Fe2+ (1) E01
et
Ce4+ + e- = Ce3+ (2) E02L'addition de la demi-réaction (1) prise de droite à gauche et de la demi-réaction (2) prise de gauche à droite élimine l'électron du bilan et mène à :
Fe2+ + Ce4+ = Fe3+ + Ce3+
Le potentiel mesuré de cette solution satisfait à la relation de Nernst de chacun des systèmes (1) et (2) :
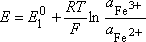
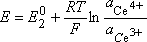
d'où

Les deux éléments d'un couple redox peuvent se trouver dans des phases différentes et la demi-réactionfaire intervenir d'autres espèces qui ne changent pas de degré d'oxydation. On en trouve de nombreux exemples dans les cours de Chimie en solution.